1.1 Átomos y compuestos
Los minerales, que son los "ladrillos" de las rocas, están formados por compuestos y/o elementos que se combinan mediante uniones atómicas de las que dependen sus propiedades. Repasamos aquí los conceptos básicos de átomos y compuestos que tienen relevancia con las características de los minerales.
Átomos y Elementos
El átomo es la más pequeña división de la materia que retiene las características químicas de un elemento. Se representa como un sistema solar en miniatura con un núcleo de protones y neutrones y hasta 7 capas de electrones orbitando alrededor del núcleo.
a) Protones.- partículas cargadas positivamente con masa de 1 uma (unidad de masa atómica)
b) Neutrones.- partículas eléctricamente neutras con masa de 1 uma
c) Electrones.- partículas de tamaño infinitesimal con carga eléctrica negativa.
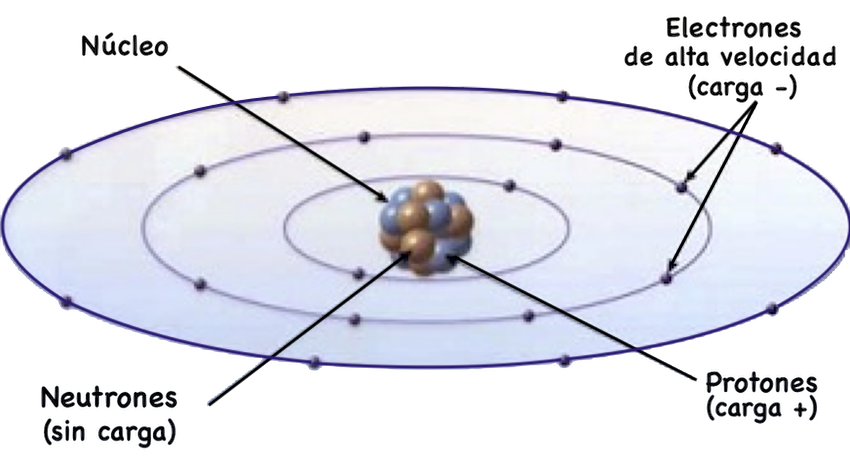
Las partículas del átomo.
Número Atómico (#a) = Número de Protones (que también es igual al número de electrones). Este número es el que le da la identidad de cada ELEMENTO.
Del número 0 al 92 son elementos que ocurren naturalmente (el 61 es excepción). Los elementos del 43, 85 y 87 son muy inestables y solo están en espectro estelar. Los elementos del números 92 en adelante, NO ocurren naturalmente y cuando se logra producirlos, son inestables.
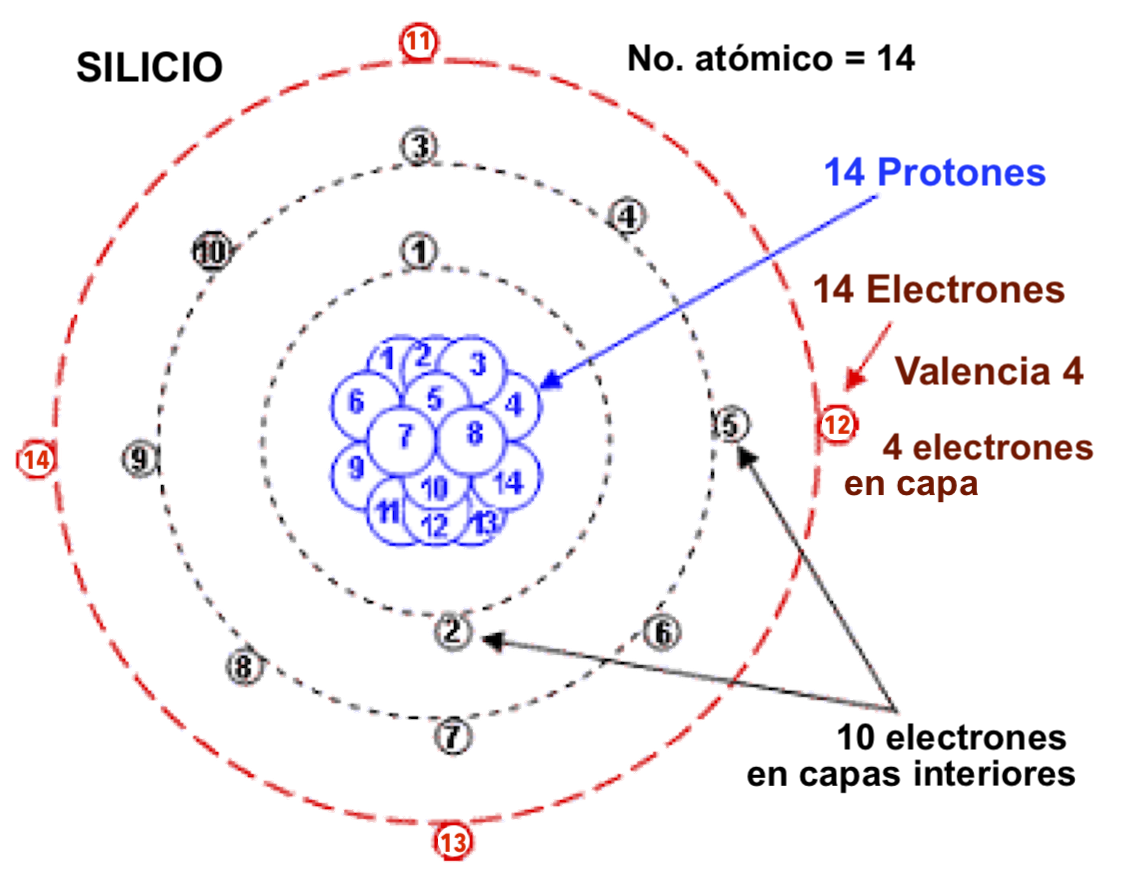
Numero atómico del Silicio (Si), uno de los elementos más abundantes en los minerales formadores de rocas.
Masa Atómica (ma) = suma de Protones más los Neutrones del núcleo. Un mismo elemento puede tener diferente masa atómica, en virtud a que el número de neutrones puede variar. Cada una de estas variaciones es un ISÓTOPO.
Ejemplo: la mayoría del hidrógeno (H) es de ma = 1 (1 protón). El deuterio es un H de ma = 2 (1 protón, 1 neutrón) y el tritio tiene ma = 3 (1 protón, 2 neutrones).
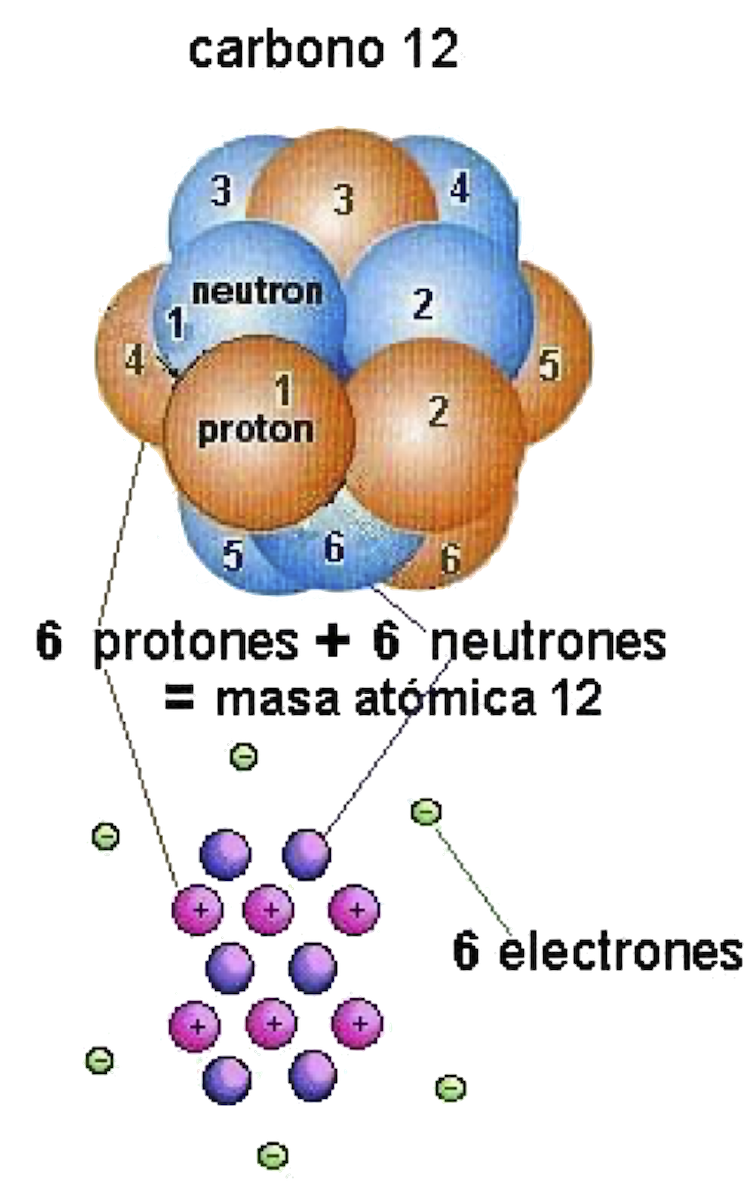
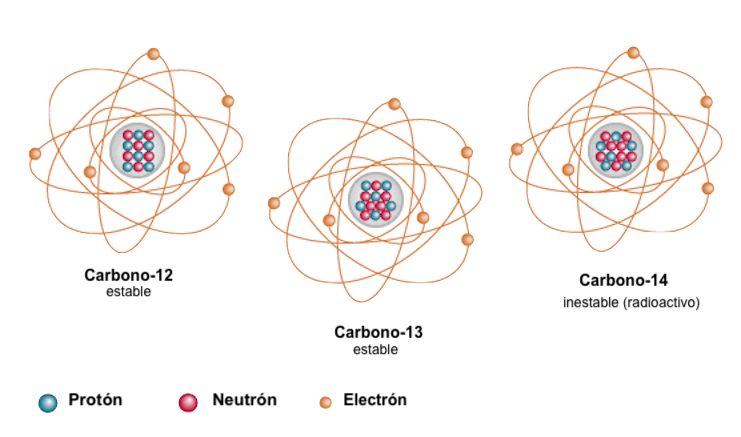
Ilustración de las partículas atómicas y masa atómica del Carbono 12.
Comparativa de los tres isótpos del Carbono: C-12 (98.9%),C-13 (1,1%) y C-14 (trazas).
Entre más protones se tengan en el núcleo, se tienen por consecuencia más electrones y más capas orbitales. En cada capa orbital hay hasta un número determinado de electrones. En la última capa el máximo es 8 electrones.
Los elementos que tienen 8 electrones en su última capa son: los gases inertes, que son los elementos más estables. El resto de los elementos tiene menos de 8 electrones en la última capa, por lo que son químicamente reactivos.
Compuestos
Los átomos de los elementos reaccionan unos con otros y forman compuestos. Con estas reacciones se llenan las últimas capas de los átomos, con lo cual quedan químicamente estables. En este proceso los átomos:
a) Ganan electrones: Aniones.- ion cargado negativamente (# electrones > # protones)
b) Pierden electrones: Cationes.- ion cargado positivamente (# electrones < # protones)
Átomos con 1, 2 ó 3 electrones en última órbita tienden a perderlos
Átomos con 4 ó más electrones en última órbita tienden a ganarlos
Ejemplos: El sodio (Na) con #a = 11 → 11 electrones distribuidos en capas así: 2, 8 y 1, esto es, pierde electrones, por lo que es catión: Na1+
El cloro (Cl) con #a = 17 → 17 electrones distribuidos: 2, 8, 7, esto es, gana electrones, por lo que es anión: Cl1-
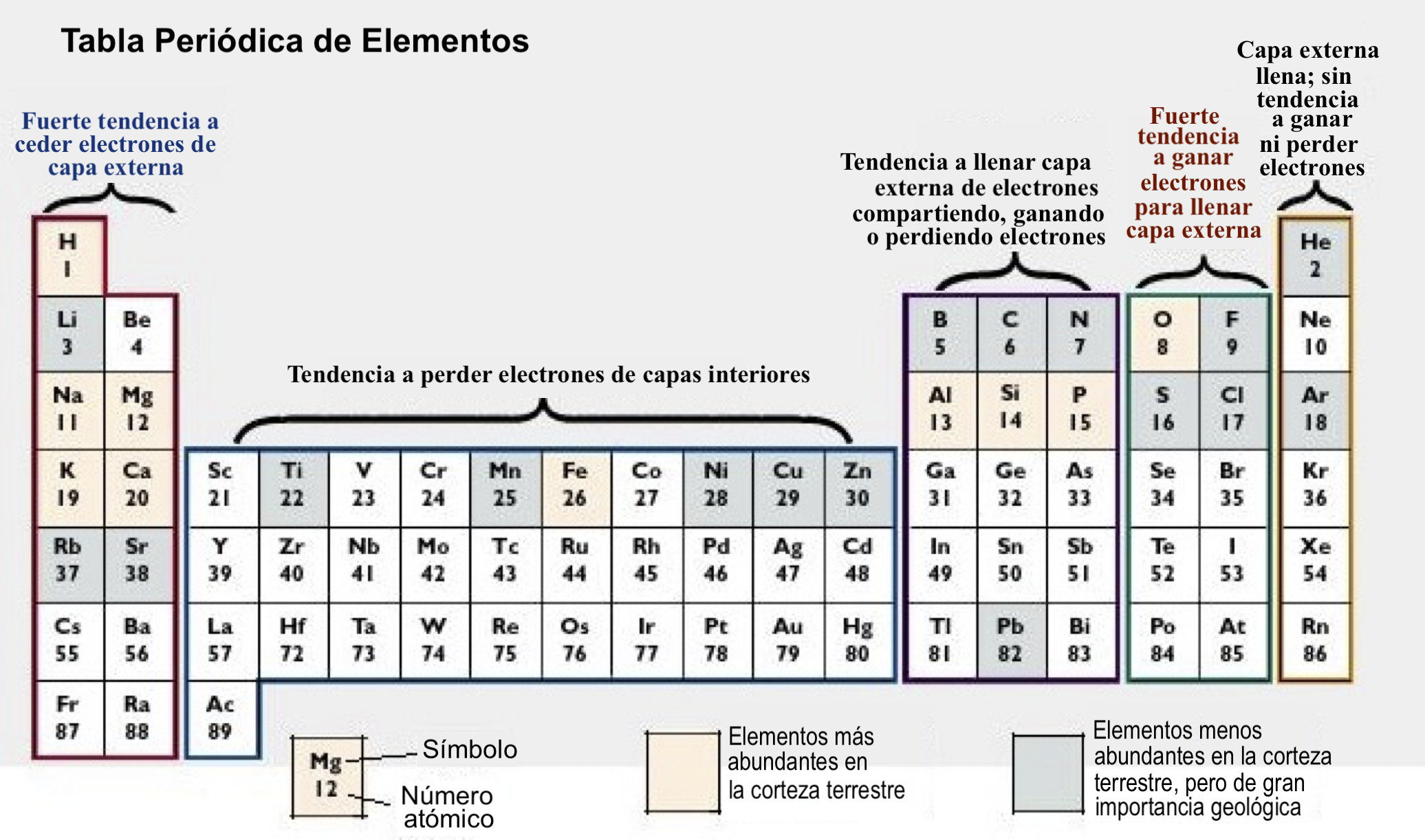
Tabla periodica de elementos que ilustra los elementos con tendencia a ceder - ganar - compartir electrones al formar compuestos
Tipo de uniones atómicas
La forma como se unen los átomos de los compuestos, condiciona en gran medida el arreglo interno ordenado de átomos que ocurre en los minerales
Iónica. El electrón externo del (1) átomo de un elemento se da al átomo de otro elemento para completar sus 8 electrones de la última capa.
Ejemplo: el cloruro de sodio (NaCl) y el fluoruro de litio (LiF). Características: solubles en agua, tienen altos puntos de fusión, son frágiles, una vez en estado sólido no conducen electricidad.
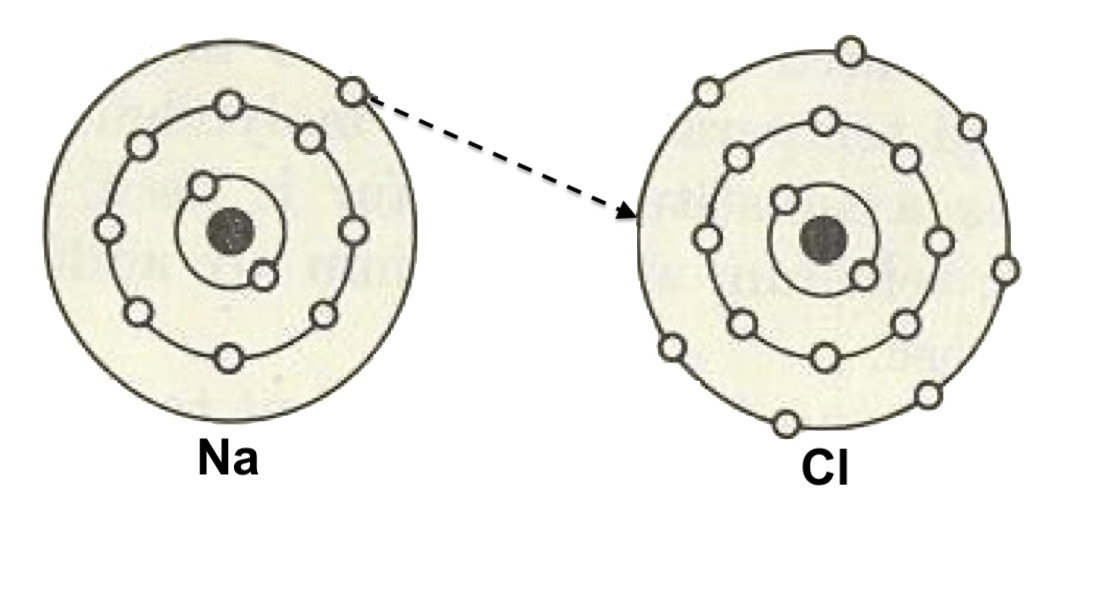
Unión iónica del Na y Cl para formar NaCl: el Na cede 1 electrón al Cl.
Covalente. Unión más fuerte: electrones de ambos átomos son compartidos. Se da entre elementos NO metálicos, la verdadera unión covalente solo se da con átomos del mismo elemento. Pueden compartir 1 par, 2 y hasta 3 pares de electrones. Los átomos así unidos así forman una molécula (ej., H-H, O-O, H-O, N-N). Características de la unión en materiales solidos: no conducen electricidad (pues carecen de iones), casi NO son solubles en agua, tienen alto punto de fusión. El ejemplo más típico es el diamante, otro es el cuarzo.
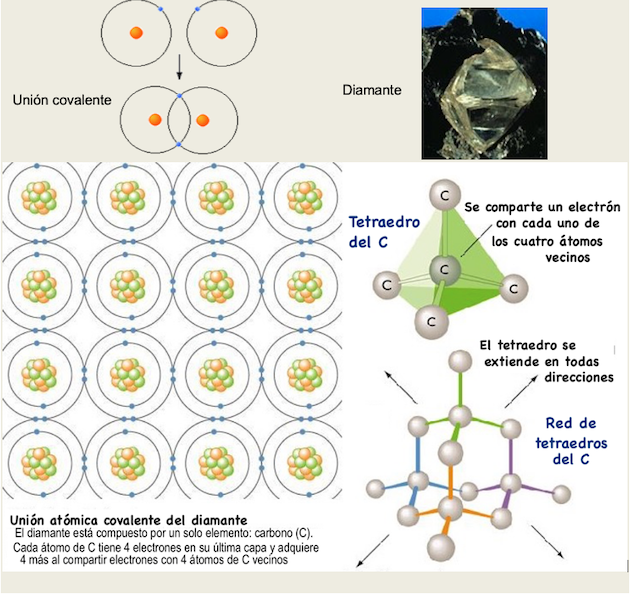
Unión covalente en el C y estructura cristalina del diamante
Metálica. Es una unión similar a una union covalentes “apretada”, porque la unión ocurre en las capas más internas de energía y los electrones externos van de un lado a otro con facilidad. Característica presentan propiedades como conductividad eléctrica, térmica.
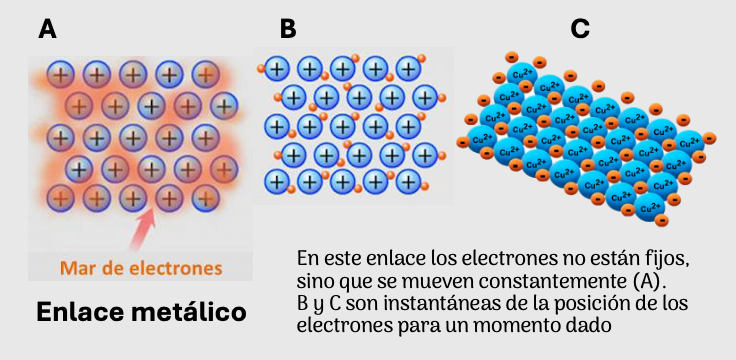
Enlace metálico, presente entre átomos de un mismo elemento metálico.
Van der Waals. Es una atracción electrostática débil entre subunidades que tienen una cierta unión iónica o covalente. Ejemplo: grafito, talco.
Iones Complejos. Son iones combinados que actúan como si fueran un solo ion, formando pares fuertemente unidos. Ejemplo: CO32- SO42- NO31- SiO4 4- .